Đăng nhập
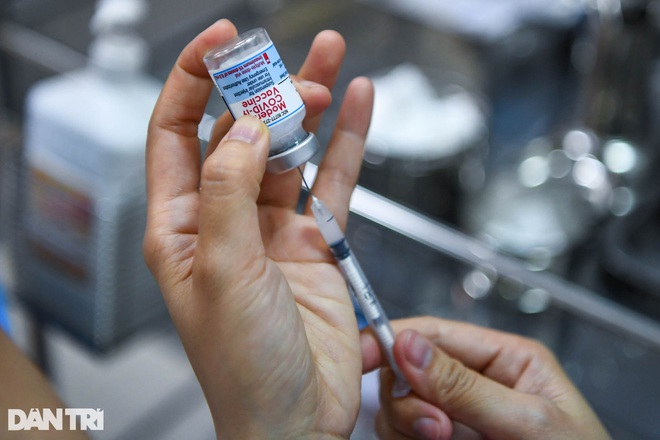
KẾT QUẢ HỌP KHẨN ĐÁNH GIÁ DỮ LIỆU THỬ NGHIỆM LÂM SÀNG VẮC XIN NANOCOVAX
Hội đồng của Bộ Y tế chưa nhận được hồ sơ, báo cáo chính thức nào về hiệu lực bảo vệ của vắc xin Nanogen. Vì thế, các đơn vị cần gửi dữ liệu này càng sớm càng tốt để ngày 15/8 Hội đồng tiếp tục họp.
Sáng 7/8, Hội đồng đạo đức trong nghiên cứu y sinh quốc gia họp khẩn để nghiệm thu kết quả thử nghiệm lâm sàng giai đoạn một, đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 2 đến thời điểm hiện tại và ghi nhận tiến độ triển khai thử nghiệm lâm sàng giai đoạn 3a (giai đoạn đầu của giai đoạn 3, hiện chưa có báo cáo kết quả chính thức).
Nội dung cuộc họp căn trên cứ tài liệu, hồ sơ của các tổ chức nhận thử (Học viện Quân Y và Viện Pasteur TPHCM) mà Công ty Cổ phần công nghệ sinh học dược Nanogen gửi Hội đồng vào ngày 3/8.

Hội đồng đạo đức trong nghiên cứu y sinh quốc gia họp khẩn sáng 7/8.
Theo đó, cho đến ngày 6/8, Hội đồng chưa nhận được hồ sơ, báo cáo chính thức nào từ các nghiên cứu viên chính và tổ chức nhận thử về hiệu lực bảo vệ của vắc xin Nanocovax.
Vì thế, Hội đồng thống nhất nghiệm thu kết quả thử nghiệm lâm sàng giai đoạn một vắc xin Nanocovax với dữ liệu theo dõi đến tháng thứ 6 kể từ liều tiêm đầu tiên của giai đoạn một trên 60 người tình nguyện với 3 mức liều 25 mcg, 50 mcg, 75 mcg. Trên cơ sở cập nhật kết quả đánh giá giữa kỳ giai đoạn 2 đến thời điểm hiện tại, Hội đồng quyết định tiếp tục cho phép triển khai thử nghiệm lâm sàng giai đoạn 3 với mức liều 25mcg theo đề cương nghiên cứu đã được phê duyệt.
Thứ trưởng Trần Văn Thuấn đánh giá, đây là cuộc họp hội đồng đạo đức đánh giá kết quả thử nghiệm lâm sàng pha một và giữa kỳ pha 2 hết sức khẩn trương, nghiêm túc, thể hiện rõ sự ủng hộ, quyết tâm, quyết liệt của Bộ Y tế đối với việc nghiên cứu phát triển vắc xin phòng chống Covid-19 trong nước.
"Chúng ta khẩn trương nhưng cần phải khoa học, chặt chẽ để đảm bảo số liệu đưa ra đủ tin cậy", Thứ trưởng Thuấn nói.
Cụ thể, Bộ Y tế đồng tình với ý kiến của Chủ tịch Hội đồng về việc cần thành lập ngay tổ hỗ trợ, phân tích, đánh giá, giám sát số liệu và quy trình của 2 đơn vị tham gia nghiên cứu thử nghiệm lâm sàng, và phải có báo cáo trước ngày 14/8.
Bộ cũng đề nghị các đơn vị nhận thử như Học viện Quân y, Viện Pasteur và đơn vị độc lập là Viện Vệ sinh dịch tễ Trung ương kết hợp với nhà sản xuất là Công ty Nanogen khẩn trương hoàn thiện, đồng thời chuẩn bị ngay và gửi cho Hội đồng và Cục Khoa học Công nghệ và Đào tạo báo cáo pha 3a.
Xem xét nghiên cứu bổ sung về việc tiêm mũi 3 vắc xin Nanocovax
Thứ trưởng Thuấn nhấn mạnh các đơn vị cần gửi càng sớm càng tốt, ngay đầu tuần tới. Trên cơ sở đó, kết hợp với kết quả của Tổ công tác, Thứ trưởng đề nghị Hội đồng tiếp tục họp vào ngày 15/8 để đánh giá kết quả giai đoạn 3a. Dựa trên kết quả đánh giá, các thành viên trong Hội đồng khuyến nghị các biện pháp khẩn thiết, cần thiết, hợp lý.
Bộ Y tế cũng đề nghị cân nhắc xem xét có tiến hành thêm một nghiên cứu bổ sung về việc tiêm mũi 3 vắc xin Nanocovax hay không, xem xét bổ sung các chủng mới của virus corona (như chủng Delta) vào nghiên cứu ở thời điểm thích hợp.
Đồng thời, Cục Khoa học Công nghệ và Đào tạo có công văn trả lời các tỉnh có công văn gửi Chính phủ, Bộ Y tế xin phép tiêm thử vắc xin Nanocovax. Bộ Y tế rất ủng hộ, tạo mọi điều kiện để các tỉnh tham gia thử nghiệm lâm sàng, tuy nhiên phải tuân thủ đúng theo các quy trình, quy định về thử nghiệm lâm sàng. Bộ rất không đồng ý việc lợi dụng ưu tiên thử nghiệm lâm sàng vào mục đích thương mại.
Thử nghiệm lâm sàng giai đoạn một, 2 vắc xin Nanocovax nhằm đánh giá bước đầu tính an toàn, khả năng dung nạp và thăm dò đáp ứng sinh miễn dịch của vắc xin nghiên cứu, chưa đánh giá hiệu lực bảo vệ của vắc xin. Đánh giá kết quả giữa kỳ giai đoạn 2 là đánh giá trong ngắn hạn tính an toàn và tính sinh miễn dịch của vắc xin nghiên cứu để xác định liều dùng tối ưu của vắc xin trong thử nghiệm lâm sàng giai đoạn 3.
Theo đề cương nghiên cứu, thử nghiệm lâm sàng giai đoạn 2 kéo dài đến tháng 2/2022. Tuy nhiên, nhằm đẩy nhanh tiến độ phát triển vắc xin, Hội đồng đã họp khẩn cấp để đánh giá kết quả giữa kỳ thử nghiệm lâm sàng giai đoạn 2 và cho phép thực hiện thử nghiệm lâm sàng giai đoạn 3 trong khi vẫn tiếp tục hoàn thiện hồ sơ đánh giá giữa kỳ giai đoạn 2 và tiếp tục triển khai giai đoạn 2 theo đề cương được duyệt.
Đối với thử nghiệm giai đoạn 3, để sớm có kết quả về tính sinh miễn dịch, Hội đồng cho phép chỉ thực hiện các xét nghiệm về tính sinh miễn dịch ở giai đoạn 3a trên 1000 người tình nguyện.
Nam Phương
Tin tức mới
 Tin tức mới
Tin tức mới TỰ LỰC - TỰ CƯỜNG VIỆT NAM : KHÔNG PHẢI PHÉP LẠ… ĐÓ LÀ THỰC TẾ MỚI
Nền kinh tế mới nổi Việt Nam không phải là một phép lạ. Đó là một thực tế.
 Tin tức mới
Tin tức mới LỢI ÍCH THIẾT THỰC TỪ KHÁM, CHỮA BỆNH BẰNG CĂN CƯỚC CÔNG DÂN GẮN CHIP
Sử dụng căn cước công dân (CCCD) gắn chip trong khám, chữa bệnh bảo hiểm y tế (BHYT) là một bước tiến lớn trong cải cách thủ tục hành chính.
 Tin tức mới
Tin tức mới GÍA BẤT ĐỘNG SẢN NĂM 2023 SẼ DIỄN BIẾN THEO XU HƯỚNG NÀO?
Thị trường BĐS 2023 được dự báo còn nhiều khó khăn nhưng việc giảm giá sản phẩm sơ cấp khó có khả năng xảy ra. Tình trạng giảm giá chỉ có thể xuất hiện ở thị trường thứ cấp hay hàng “ngộp” ở phân khúc cao cấp.
 Tin tức mới
Tin tức mới DỰ BÁO HÀNG TIÊU DÙNG VÀ TRIỂN VỌNG BÁN LẺ NĂM 2023
Trước thềm năm 2023, phân ban Tình báo kinh tế (EIU), Tập đoàn Economist (Anh) đã công bố dự báo cho 7 lĩnh vực. Dưới đây là những “điểm nhấn” liên quan tới hàng tiêu dùng và triển vọng bán lẻ năm 2023 thuộc lĩnh vực công nghiệp.
 Tin tức mới
Tin tức mới XÂY DỰNG CƠ CHẾ CHÓNG RỬA TIỀN CÓ HIỆU QUẢ Ở VIỆT NAM
Theo Quyết định số 1945/QĐ-NHNN, Ngân hàng Nhà nước đặt mục tiêu xây dựng một cơ chế phòng, chống rửa tiền có hiệu quả ở Việt Nam, góp phần bảo vệ tốt nhất lợi ích của quốc gia, của các tổ chức và cá nhân trong nền kinh tế, tăng cường sự ổn định của hệ th
 Tin tức mới
Tin tức mới SÁU XU HƯỚNG SẼ ĐỊNH HÌNH TƯƠNG LAI VIỆT NAM
Ông Tim Evans, Tổng Giám đốc HSBC Việt Nam đã có những dự báo liên quan đến 6 xu hướng sẽ định hình tương lai Việt Nam trong thời gian tới...
 Tin tức mới
Tin tức mới KINH TẾ RUMANI NĂM 2021 PHÁT TRIỂN VÀ THÁCH THỨC
Dịch bệnh Covid-19 bùng phát mạnh trên toàn thế giới từ quí 2 năm 2020 đã ảnh hưởng rất trầm trọng đến sự phát triển kinh tế của các nước đặc biệt là Liên minh Châu Âu (EU) trong đó có Rumani.
 Tin tức mới
Tin tức mới NGỪNG THỬ NGHIỆM GIAI ĐOẠN BA VACCINE COVIVAC
Nhóm nghiên cứu vaccine Covid-19 Covivac quyết định ngừng thử nghiệm giai đoạn ba do khó khăn trong tìm tuyển tình nguyện viên đủ điều kiện.
 Tin tức mới
Tin tức mới "CÁN BỘ THẤY NĂNG LỰC CÓ VẤN ĐỀ ĐƯỢC ĐẢNG TẠO ĐIỀU KIỆN TỪ CHỨC"
Theo Trưởng Ban tổ chức Trung ương Trương Thị Mai, Bộ Chính trị sắp ban hành quy định về "chế tài" miễn nhiệm và từ chức. Với cán bộ thấy năng lực "có vấn đề" được Đảng tạo điều kiện được từ chức...
 Tin tức mới
Tin tức mới KINH TẾ TUẦN HOÀN - CHÌA KHÓA VÀNG ĐƯA NỀN KINH TẾ TOÀN CẦU VƯỚT QUA ĐẠI DỊCH
Covid-19 đóng lại nhiều cánh cửa, đặt ra nhiều thách thức cho nền kinh tế. Đổi mới sáng tạo, thúc đẩy thương mại toàn cầu chính là "chìa khóa vạn năng" đưa doanh nghiệp bước tới "cánh cửa cơ hội".
 Tin tức mới
Tin tức mới BỘ Y TẾ: ƯU TIÊN VẮC XIN CHO LỰC LƯỢNG Y TẾ, NGƯỜI CAO TUỔI, CÓ BỆNH NỀN
Thời gian qua, tại một số điểm tiêm vắc xin Covid-19 vẫn có biểu hiện xác định đối tượng ưu tiên chưa đúng quy định, gây bức xúc cho người dân. Bộ Y tế tiếp tục có văn bản hỏa tốc chấn chỉnh.
 Tin tức mới
Tin tức mới HIỆU QUẢ CỦA VẮC XIN VỚI CÁC BIẾN THỂ DELTA NHƯ THẾ NÀO?
Theo WHO, đến nay vắc xin vẫn có hiệu quả tốt trong việc ngăn ngừa mắc bệnh nặng Covid-19 bởi biến thể Delta, mặc dù có giảm hiệu quả trong việc ngăn ngừa mắc bệnh có triệu chứng.
 Tin tức mới
Tin tức mới VACCINE COVID-19 HIỆU QUẢ NHƯ THẾ NÀO TRONG THỰC TẾ?
Nhiều loại vaccine đã được triển khai khắp thế giới để chạy đua với Covid-19, nhưng câu hỏi đặt ra là hiệu quả thực tế của chúng như thế nào.
 Tin tức mới
Tin tức mới ADB NÂNG DỰ BÁO TĂNG TRƯỞNG KINH TẾ VIỆT NAM NĂM NAY
Ngân hàng Phát triển Châu Á (ADB) vừa công bố báo cáo Triển vọng Phát triển Châu Á 2021, trong đó dự báo tăng trưởng kinh tế Việt Nam sẽ đạt mức 6,7% trong năm nay và 7% trong năm 2022.
 Tin tức mới
Tin tức mới NANOCOVAX CỦA VIỆT NAM KỲ VỌNG TỐT NGANG VẮC XIN NGOẠI, CÔNG SUẤT 100 TRIỆU LIỀU/NĂM
Kết quả thử nghiệm vắc xin Nanocovax có nhiều tín hiệu khả quan. Trường hợp được cấp phép khẩn cấp, Việt Nam có thể sản xuất 100 triệu liều/năm.
 Tin tức mới
Tin tức mới XÂY DỰNG CÁC MÔ HÌNH CHUỖI CUNG ỨNG NÔNG SẢN AN TOÀN THỰC PHẨM
Trong giai đoạn hiện nay, Thứ trưởng Bộ NN&PTNT Trần Thanh Nam cho rằng, cần cố gắng xây dựng các mô hình theo chuỗi để làm sao giúp tiêu thụ được nông sản;
 Tin tức mới
Tin tức mới 5 THÁNG ĐẦU NĂM, FDI CHIẾM GẦN 70% GIÁ TRỊ XUẤT KHẨU
Tính trong 5 tháng đầu năm 2021, khu vực FDI có trị giá xuất nhập khẩu ước đạt 182,82 tỷ USD, chiếm 69,8% tổng trị giá xuất nhập khẩu của cả nước và tăng 38,2 % so với cùng kỳ năm trước.
 Tin tức mới
Tin tức mới VẮC XIN COVIVAC TIÊM THỬ NGHIỆM XONG GIAI ĐOẠN 1
120 tình nguyện viên tham gia thử nghiệm giai đoạn 1 đã hoàn tất đủ 2 mũi tiêm. Giữa tháng 6 tới có thể bắt đầu giai đoạn 2.
 Tin tức mới
Tin tức mới XỬ LÝ NGƯỜI ĐỨNG ĐẦU NẾU ĐỂ XẨY RA DỊCH BỆNH, TRÌ TRỆ SẢN XUẤT DO CHỦ QUAN
Thủ tướng Phạm Minh Chính triệu tập cuộc họp trực tuyến khẩn cấp với lãnh đạo 6 tỉnh biên giới Tây Nam về công tác phòng chống dịch COVID 19;
 Tin tức mới
Tin tức mới NHIỆM KỲ VÀ SÂN BAY
Trong số khoảng 50 chuyến bay mỗi năm của tôi trước dịch Covid, hầu hết các lần bị delay đều từ Nội Bài và Tân Sơn Nhất.
 Tin tức mới
Tin tức mới KIẾN TRÚC SƯ "ĐIỂM MẶT" YẾU TỐ MẤT AN TOÀN CỦA NHÀ ỐNG
Cùng với bất lợi về không gian, nhiều gia chủ không tính toán đến các nguy cơ khi xây dựng nhà ống, ảnh hưởng đến chất lượng sống và khả năng thoát hiểm khi có sự cố.
HÀNG KHÔNG TÁI KHỞI ĐỘNG BAY THƯƠNG MẠI QUỐC TẾthương mại quốc tế
Các hãng bay cho biết đang cùng các cơ quan trong và ngoài nước nghiên cứu, xây dựng, thử nghiệm 'hộ chiếu vắc xin' cũng như phương án mở lại đường bay quốc tế một cách an toàn.
 Tin tức mới
Tin tức mới ĐỂ KINH TẾ TƯ NHÂN TĂNG TỐC
Triển khai Nghị quyết Đại hội XIII của Đảng và Nghị quyết 10/NQ-TW về phát triển kinh tế tư nhân trở thành động lực quan trọng, ngay tuần đầu sau Tết Tân Sửu, Thường trực Chính phủ đã họp
 Tin tức mới
Tin tức mới NĂM SỬU KỂ CHUYỆN TRÂU
Người ta tin rằng trong 12 con Giáp, chỉ có "Năm Trâu mưa thuận gió hòa", nên trên trang đầu các cuốn "nông lịch" ngày xưa, bao giờ cũng in hình con trâu kéo cày.
 Tin tức mới
Tin tức mới HẠ LONG
Nơi hoàng hôn không muốn rời xa biển Nơi bình minh vương sóng nhẹ xô bờ
 Tin tức mới
Tin tức mới VIỆT NAM HƯỚNG TỚI MỘT QUỐC GIA PHÁT TRIỂN
Hôm nay (25.1), tại Hà Nội khai mạc Đại hội toàn quốc lần thứ XIII của Đảng. Đây là sự kiện vô cùng trọng đại với đất nước Việt Nam cả hiện tại và tương lai.
 Tin tức mới
Tin tức mới VĂN HÓA PHẢI THỰC SỰ LÀ NỀN TẢNG, NGUỒN LỰC PHÁT TRIỂN CỦA ĐẤT NƯỚC
Văn hóa góp phần khơi dậy những giá trị tốt đẹp, làm cho mỗi người dân Việt Nam thấy thêm yêu nước,
 Tin tức mới
Tin tức mới QUY MÔ KINH TẾ VIỆT NAM VƯỢT 1 NGHÌN TỶ USD THEO SỨC MUA TƯƠNG ĐƯƠNG
Theo đánh giá của IMF, nếu tính theo sức mua tương đương, quy mô nền kinh tế nước ta đạt 1,05 nghìn tỷ USD và GDP bình quân đầu người đạt trên 10 nghìn USD.
 Tin tức mới
Tin tức mới KHÁNG SINH SỬ DỤNG TRONG CHĂN NUÔI TAI HỌA RÌNH RẬP CỘNG ĐỒNG
Vi sinh kháng kháng sinh đang là nỗi lo trong chăm sóc sức khỏe cộng đồng có liên quan trực tiếp từ chăn nuôi.
 Tin tức mới
Tin tức mới NHIỀU CHƯƠNG TRÌNH KÍCH CẦU DU LỊCH HẤP DẪN
Theo kết quả khảo sát của Hội đồng tư vấn du lịch (TAB), hơn 41% số người Việt Nam được hỏi đã sẵn sàng đi du lịch ngay từ tháng 9 - 11 năm nay
 Tin tức mới
Tin tức mới QUY HOẠCH PHÂN KHU SÔNG HỒNG SẼ GIÚP HÀ NỘI KHANG TRANG, HIỆN ĐẠI
Chiều ngày 21/8/2020, Thường trực Thành ủy Hà Nội có cuộc làm việc với Ban Cán sự Đảng Bộ Xây dựng về kết quả phối hợp công tác giữa Bộ Xây dựng và UBND TP Hà Nội.
 Tin tức mới
Tin tức mới NHỮNG CÔNG TRÌNH GIAO THÔNG NGHÌN TỶ THAY ĐỔI DIỆN MẠO QUẢNG NINH
Những công trình giao thông với nguồn kinh phí lớn là đòn bẩy giúp kinh tế Quảng Ninh có bước phát triển nhảy vọt trong 5 năm vừa qua.
 Tin tức mới
Tin tức mới GIÁ TRỊ CỦA TỰ DO
Dẫu thời gian có đổi thay, nhưng giá trị to lớn của cách mạng tháng Tám cùng những ước vọng thiêng liêng về độc lập, tự do,
 Tin tức mới
Tin tức mới KINH TẾ VIỆT NAM 6 THÁNG CUỐI NĂM: NHỮNG CHỈ BÁO QUAN TRỌNG
Mặc dù tín hiệu lạc quan cho tăng trưởng cuối năm đã có, đó là sự hồi phục của ngành công nghiệp, tuy nhiên các yếu tố quyết định đến tăng trưởng còn là tình hình dịch bệnh trên thế giới, đầu tư công…
 Tin tức mới
Tin tức mới KHOẢNG MỘT NĂM NỮA VIỆT NAM MỚI TIẾP CẬN NGUỒN VẮC XIN COVID -19
Quyền Bộ trưởng Y tế Nguyễn Thanh Long cho biết, dự báo trong 6 tháng cuối năm 2021 Việt Nam mới có thể tiếp cận với nguồn vắc xin phòng Covid-19.
 Tin tức mới
Tin tức mới KIÊN QUYẾT ĐẤU TRANH VỚI VI PHẠM CHỦ QUYỀN, CHỐNG PHÁ TA VỀ DÂN CHỦ
Chiều ngày 8/7/2020, tại trụ sở Chính phủ, Phó thủ tướng Phạm Bình Minh, Trưởng Ban chỉ đạo liên ngành hội nhập quốc tế về chính trị, an ninh, quốc phòng
 Tin tức mới
Tin tức mới KỲ VỌNG HAI TỶ LIỀU VACCINE VÀO NĂM TỚI
Tổ chức Y tế Thế giới (WHO) hy vọng các quốc gia có thể sản xuất hàng trăm triệu liều vaccine vào năm nay và hai tỷ liều cho đến cuối năm 2021.
 Tin tức mới
Tin tức mới SỰ THỨC TỈNH CỦA CON NGƯỜI SAU ĐẠI DỊCH
Trước đại dịch Covid-19, toàn cầu hóa là câu nói cửa miệng của phần đông nhân loại. Dĩ nhiên, toàn cầu hóa luôn có hai mặt sáng, tối. Mặt sáng dễ nhận hơn, mặt tối nhiều người biết nhưng nhắm mắt cho qua, vì những lợi ích mà mặt sáng mang lại.
 Tin tức mới
Tin tức mới GIỚI NHÀ GIẦU GIA TĂNG XU HƯỚNG TIÊU DÙNG BẤT ĐỘNG SẢN THAY ĐỔI RA SAO?
Sự bùng nổ của tầng lớp trung lưu, người giàu tại Việt Nam trong những năm vừa qua cũng tác động lên xu hướng tiêu dùng bất động sản.
 Tin tức mới
Tin tức mới CHỐN BÌNH YÊN
Bà cháu trồng hoa, ông cuốc đất Giữa quê hương nghĩ mình sướng thật Chẳng thấy Virus nào lảng vảng nơi đây Chỉ có bầu trời thơm ngát hương cây!
 Tin tức mới
Tin tức mới SỬA ĐỔI QUY ĐỊNH VỀ BỒI THƯỜNG KHI NHÀ NƯỚC THU HỒI ĐẤT
Thủ tướng Nguyễn Xuân Phúc vừa ký ban hành Nghị định 06/2020/NĐ-CP của Chính phủ sửa đổi, bổ sung
 Tin tức mới
Tin tức mới CHUYỆN CHUỘT NĂM TÝ
12 con vật trong 12 con giáp, các con vật thuộc loài có bốn chân thì chuột là loài nhỏ con nhất
 Tin tức mới
Tin tức mới VIỆT NAM - RUMANI: HƯỚNG TỚI CƠ CHẾ HỢP TÁC THỰC CHẤT VÀ HIỆU QUẢ
Tại Khóa họp lần thứ 16 của Ủy ban hỗn hợp Việt Nam - Romania về hợp tác kinh tế, Bộ trưởng Trần Tuấn Anh đã khẳng định Khóa họp lần này là một bước nối tiếp quan trọng để đưa cơ chế hợp tác UBHH giữa Việt Nam và Romania theo hướng thực chất và hiệu quả,
 Tin tức mới
Tin tức mới HUY ĐỘNG NGUỒN LỰC THÚC ĐẨY NGÀNH CÔNG NGHIỆP NỀN TẢNG
Sáng 24/9, tại Hà Nội, Hội nghị chuyên đề về các giải pháp thúc đẩy phát triển ngành cơ khí Việt Nam đã khai mạc.
 Tin tức mới
Tin tức mới GIÁO SƯ LÃ NGỌC KHUÊ: BA ĐIỂM YẾU KHIẾN VIỆT NAM "THẤT THỐ" Ở CÁC TUYẾN ĐƯỜNG SẮT ĐÔ THỊ
"Thực tiễn và kinh nghiệm sản xuất lại càng là một con số không, làm sao có thể dựa vào những gì chúng ta vốn có. Trên thực tế chúng ta đã không thể hình dung ra hết những việc phải làm. Ngay cả việc kí kết hợp đồng cũng không đưa ra đủ những điều khoản c
 Tin tức mới
Tin tức mới MINH BẠCH HOÁ QUI ĐỊNH VỀ ĐẦU TƯ
Danh mục ngành, nghề tiếp cận thị trường có điều kiện đối với nhà đầu tư nước ngoài đã xuất hiện trong dự thảo Luật sửa đổi...
 Tin tức mới
Tin tức mới ZALO KHÔNG MUỐN LÀ MẠNG XÃ HỘI?
Khi Thanh tra Sở Thông tin và Truyền thông Tp.HCM có văn bản đề nghị thu hồi hai tên miền Zalo.vn và Zalo.me thuộc sở hữu của Công ty Cổ phần VNG vì không có giấy phép thiết lập mạng xã hội, thì nhiều người mới ngã ngửa và không khỏi ngạc nhiên vì Zalo là
 Tin tức mới
Tin tức mới VIỆT NAM CÓ BAO NHIÊU HÃNG HÀNG KHÔNG LÀ VỪA?
Thị trường hàng không Việt Nam được đánh giá là khá “béo bở” và được nhiều nhà đầu tư quan tâm, song việc sắp tới khi nào sẽ có thêm một hãng hàng không tham gia thị trường vẫn còn là dấu hỏi.
 Tin tức mới
Tin tức mới BỨC TRANH DOANH NGHIỆP NHÀ NƯỚC NĂM 2018: DOANH THU 193.510 tỷ, LÃI 26.425 tỷ
Bộ Kế hoạch và Đầu tư vừa có văn bản gửi Chính phủ báo cáo tình hình phát triển doanh nghiệp năm 2018 và nhận định năm 2019.
 Tin tức mới
Tin tức mới ĐƯỜNG SẮT TỐC ĐỘ CAO BẮC NAM: SỰ LỰA CHỌN NÀO LÀ ĐÍCH ĐÁNG?
Báo chí mấy ngày nay đưa ra nhiều góc nhìn khác nhau về dự án Đường sắt tốc độ cao Bắc Nam, trong đó tập trung bình phẩm về tổng mức đầu tư dự án. Đó là yếu tố quan trọng phải được đặt lên bàn cân xem xét khi quyết định đầu tư.
 Tin tức mới
Tin tức mới “VIỆT NAM PHẢI HÀNH ĐỘNG NHANH BỚI DÂN SỐ VÀNG CHỈ CÒN 22 NĂM NỮA!”
Phát biểu tại hội thảo: "Hướng tới tăng trưởng có chất lượng trong giai đoạn 2021-2030" ngày 7/6,
 Tin tức mới
Tin tức mới BÀI THƠ THÁNG TƯ
Nếu không làm thơ lại sợ em buồn Mà không làm thơ đâu còn là anh nữa?
 Tin tức mới
Tin tức mới ĐƯA QUAN HỆ HỢP TÁC HỮU NGHỊ TRUYỀN THỐNG VIỆT NAM - ROMANIA ĐI VÀO CHIỀU SÂU, THỰC CHẤT
Nhận lời mời của Thủ tướng Romania Viorica Dancila, Thủ tướng Chính phủ Việt Nam Nguyễn Xuân Phúc và Phu nhân sẽ thăm chính thức Romania từ ngày 14 - 16/4/2019.
 Tin tức mới
Tin tức mới MÔ HÌNH NÀO CHO PHÁT TRIỂN 5G TẠI VIỆT NAM?
Việt Nam đã chính thức "khởi động chuyến tàu 5G".
 Tin tức mới
Tin tức mới VỮNG BƯỚC LÊN
Chúc anh Khổng Văn Đương luôn gặp điều may mắn và sẽ nhanh lành bệnh. Tất cả bạn bè vẫn luôn nhắc tới anh.
 Tin tức mới
Tin tức mới 5 ĐIỂM TÍCH CỰC MỸ - TRIỀU ĐẠT ĐƯỢC SAU HỘI NGHỊ THƯỢNG ĐỈNH TẠI VIỆT NAM
Mặc dù không đạt được thỏa thuận cuối cùng, song hội nghị thượng đỉnh Mỹ - Triều lần hai tại Việt Nam vẫn mang lại những điểm sáng tích cực cho mối quan hệ đang ấm dần lên giữa hai nước.
 Tin tức mới
Tin tức mới CÁCH NHẬN BIẾT RƯỢU VANG THẬT GIẢ
Rượu vang thật khi tiếp xúc với baking soda sẽ đổi màu hoặc màu đậm hơn, còn rượu vang giả không phản ứng.
 Tin tức mới
Tin tức mới DÂN SỐ VIỆT NAM ĐẠT GẦN 95 TRIỆU NGƯỜI, ĐỨNG THỨ 14 CÁC NƯỚC ĐÔNG DÂN NHẤT THẾ GIỚI
Tổng cục Dân số-Kế hoạch hóa gia đình (DS-KHHGĐ), Bộ Y tế cho biết dân số nước ta hiện là 94,67 triệu người, đứng thứ 14 trong số các quốc gia đông dân nhất thế giới.
 Tin tức mới
Tin tức mới VÌ SAO KINH TẾ TƯ NHÂN MÃI CHƯA CHỊU LỚN?
ột trong những nguyên nhân là môi trường kinh doanh không an toàn, còn tiềm ẩn nhiều rủi ro liên quan tới thể chế...
 Tin tức mới
Tin tức mới CHUYỆN TÌNH DƯỚI CHÂN CARPATI (P1)
Truyện ngắn của Thy An Yêu quý tặng các anh chị em, bạn học lưu học sinh tại România
 Tin tức mới
Tin tức mới VỀ MIỀN KÝ ỨC
Đoàn cựu sinh viên Việt Nam chúng tôi trở lại Romania sau hơn 40 năm, với niềm náo nức. Về lại mảnh đất từng gắn bó với những năm tháng mộng mơ của tuổi học trò, ai cũng thấy mình như trẻ lại.
 Tin tức mới
Tin tức mới NGHỀ TƯ VẤN CHIẾN LƯỢC TẠI VIỆT NAM: BÓNG DÁNG SAU NHIỀU THƯƠNG VỤ SÁP NHẬP LỚN
Tại sao bên cạnh nhiều thương vụ mua bán, sáp nhập (M&A) doanh nghiệp hoặc tái cấu trúc doanh nghiệp diễn ra thành công, mang lại kết quả tốt cho chủ doanh nghiệp, thì lại có không ít thương vụ là "trái đắng" thay vì "quả ngọt"?
 Tin tức mới
Tin tức mới VINGROUP TIÊN PHONG XÂY DỰNG ĐẠI ĐÔ THỊ TẠI VIỆT NAM
Vingroup đã bắt tay triển khai mô hình "đại đô thị" đẳng cấp Singapore và hơn thế nữa, để giải quyết nhu cầu nhà ở tại Việt Nam
 Tin tức mới
Tin tức mới ĐỊNH HƯỚNG MỚI TRONG ƯU ĐẠI ĐẦU TƯ VÀO VIỆT NAM
Ngày 10/7, tại Hà Nội, Bộ Kế hoạch và Đầu tư phối hợp với Bộ Tài chính tổ chức hội thảo chuyên đề “Ưu đãi đầu tư, giao dịch liên kết: Thực trạng và giải pháp”, nhằm cập nhật và chia sẻ với các DN về những góc nhìn và định hướng của các chính sách ưu đãi đ
 Tin tức mới
Tin tức mới DIỄN ĐÀN KINH TẾ THẾ GIỚI 2018 TẠI VIỆT NAM SẼ THẢO LUẬN NHỮNG VẤN ĐỀ GÌ?
Diễn đàn Kinh tế Thế giới về ASEAN 2018 dự kiến có khoảng gần 60 phiên thảo luận, tập trung vào những vấn đề chính phủ, doanh nghiệp và người dân các nước ASEAN, trong đó có Việt Nam đang quan tâm trong bối cảnh Cách mạng công nghiệp lần thứ tư.
 Tin tức mới
Tin tức mới CƠ HỘI ĐỂ DOANH NGHIỆP VIỆT "NÂNG CẤP"
Đây là sự kiện kinh tế đặc biệt của nước chủ nhà do VCCI chủ trì tổ chức nhân dịp Diễn đàn Kinh tế Thế giới về ASEAN 2018...
 Tin tức mới
Tin tức mới NHỮNG LƯU Ý KHI ĐẦU TƯ BẤT ĐỘNG SẢN NGHỈ DƯỠNG
Những năm gần đây, đầu tư bất động sản nghỉ dưỡng được cho là kênh đầu tư hấp dẫn.
 Tin tức mới
Tin tức mới ĐÃ CÓ HƠN 800 DỰ ÁN THỦY ĐIỆN ĐƯỢC PHÊ DUYỆT TẠI VIỆT NAM
Hiện, có 385 dự án thủy điện được đưa vào khai thác sử dụng, đang xây dựng 143 dự án và đang nghiên cứu đầu tư 290 dự án...
 Tin tức mới
Tin tức mới CỘNG ĐỒNG NGƯỜI VIỆT Ở ROMANIA GIỮ GÌN GỐC RỄ VĂN HÓA QUÊ NHÀ
Giao tiếp bằng tiếng Việt, sum vầy ngày lễ, tết truyền thống chính là con đường ngắn nhất để gìn giữ văn hóa Việt.
 Tin tức mới
Tin tức mới VIỆT NAM CÓ TỶ LỆ PHỤ NỮ LÀM CHỦ DOANH NGHIỆP CAO NHẤT ĐÔNG NAM Á
Tỷ lệ phụ nữ Việt Nam tham gia thị trường lao động cũng khá cao, đạt 73%...
 Tin tức mới
Tin tức mới ƯU TIÊN PHÁT TRIỂN NÔNG NGHIỆP CÔNG NGHỆ CAO, THỰC PHẨM SẠCH, AN TOÀN
Theo Sở Nông nghiệp và Phát triển nông thôn Hà Nội, đến nay, giá trị sản phẩm nông nghiệp ứng dụng CNC trên địa bàn Thành phố hiện nay đạt 25%,
 Tin tức mới
Tin tức mới CHÂU Á ĐANG TIÊN PHONG TRONG SỰ PHÁT TRIỂN CỦA THÀNH PHỐ THÔNG MINH
Báo cáo mới của McKinsey dự báo, các thành phố lớn của châu Á, với thế hệ trẻ có mức hiểu biết cao, đang đóng một vai trò quan trọng trong việc “thông minh hóa” các cơ sở hạ tầng công nghệ.
 Tin tức mới
Tin tức mới CHÍNH PHỦ QUYẾT NGHỊ NHIỀU NỘI DUNG QUAN TRỌNG VỀ KINH TẾ
Nhiều nội dung quan trọng về kinh tế - xã hội tại phiên họp thường kỳ tháng 5 của Chính phủ vừa được cụ thể hóa bằng nghị quyết...
 Tin tức mới
Tin tức mới 7 TRIỆU NGƯỜI CHẾT MỖI NĂM VÌ Ô NHIỄM KHÔNG KHÍ
Ô nhiễm không khí tới mức độc hại đang cướp đi mạng sống của khoảng 7 triệu người trên thế giới mỗi năm
 Tin tức mới
Tin tức mới HUY ĐỘNG ĐẦU TƯ PHÁT TRIỂN HỆ THỐNG ĐƯỜNG SẮT ĐÔ THỊ HÀ NỘI
Phó Thủ tướng Trịnh Đình Dũng vừa có ý kiến chỉ đạo về chủ trương đầu tư 3 dự án đầu tư xây dựng các tuyến đường sắt đô thị Hà Nội.
 Tin tức mới
Tin tức mới NHỮNG BỆNH THƯỜNG GẶP LÚC GIAO MÙA VÀ CÁCH PHÒNG TRÁNH
Lúc giao mùa, thời tiết và độ ẩm không khí thay đổi thất thường khiến cơ thể không thích ứng kịp, tạo điều kiện cho virus, vi khuẩn gây bệnh đường hô hấp hoạt động mạnh.
 Tin tức mới
Tin tức mới PHÒNG CHÁY CHỮA CHÁY TẠI CĂN HỘ THÔNG MINH CẦN NHỮNG YÊU CẦU NÀO?
Nguy cơ cháy nổ tại các chung cư luôn là mối quan tâm hàng đầu của người dân và xã hội. Bỏ qua những khu chung cư cũ và lạc hậu về công nghệ, gần đây,
 Tin tức mới
Tin tức mới ĐƯỜNG SẮT CÁT LINH - HÀ ĐÔNG CHẠY THỬ TỪ 2/9/2018
Theo báo cáo của Bộ Giao thông gửi Chính phủ, ngày 2/9 tàu Cát Linh - Hà Đông sẽ chạy thử trên toàn tuyến với thời gian từ 3 đến 6 tháng.
 Tin tức mới
Tin tức mới ĐƠN GIẢN HÓA HÀNG LOẠT THỦ TỤC VỀ BÁO CHÍ VÀ MẠNG XÃ HỘI
Chính phủ quyết định đơn giản hóa thủ tục "Cấp giấy phép hoạt động báo chí điện tử"...
 Tin tức mới
Tin tức mới HƠN 210.000 NGƯỜI VÀO VIỆN CẤP CỨU DỊP TẾT
Bộ Y tế ghi nhận các cơ sở khám chữa bệnh cả nước đã khám, cấp cứu cho hơn 210.000 bệnh nhân, nhiều nhất vào mùng 3 và 4..
 Tin tức mới
Tin tức mới NGƯỜI TIÊU DÙNG VIỆT NAM LẠC QUAN THỨ 5 THẾ GIỚI
Theo công bố mới nhất của Nielsen, trong quý 3/2017, niềm tin của người tiêu dùng Việt Nam đạt 116 điểm, điều này tiếp tục giúp Việt Nam trở thành quốc gia có mức độ lạc quan cao thứ 5 toàn cầu.
 Tin tức mới
Tin tức mới BỐN XU HƯỚNG PHÁT TRIỂN CỦA THỊ TRƯỜNG BẤT ĐỘNG SẢN NĂM 2018
Nguồn cung năm nay dự kiến còn lớn hơn năm 2017 do có nhiều dự án đến thời điểm hoặc đủ điều kiện ra hàng...
 Tin tức mới
Tin tức mới CHÍNH PHỦ NÊU HÀNG LOẠT MỤC TIÊU KINH TẾ- XÃ HỘI CHO NĂM 2018
Hàng loạt chỉ tiêu về kinh tế - xã hội và trọng tâm chỉ đạo điều hành nền kinh tế trong năm 2018 đã được Chính phủ thông qua...
 Tin tức mới
Tin tức mới ĐỂ KHÁCH DU LỊCH NƯỚC NGOÀI QUAY TRỞ LẠI VIỆT NAM
Việt Nam cần có những tổ hợp vui chơi, giải trí và du lịch xứng tầm quốc tế để có thể khiến khách xuống hầu bao thật nhiều và không chỉ đến Việt Nam một lần...
 Tin tức mới
Tin tức mới LÀM GÌ ĐỂ BIẾT SỔ TIẾT KIỆM CÒN HAY MẤT?
Dưới đây là 5 cách đơn giản giúp người gửi biết tiền đã vào hệ thống ngân hàng hợp lệ và an toàn hay chưa.
 Tin tức mới
Tin tức mới 5 DỰ BÁO LẠC QUAN VỀ THỊ TRƯỜNG BẤT ĐỘNG SẢN NĂM 2017
Việc các ông lớn bất động sản đang rầm rộ công bố sẽ ra lò hàng trăm nghìn căn nhà giá rẻ trong nửa thập niên tới được đánh giá là một trong những cú hích mạnh mẽ cho thị trường địa ốc 2017.
 Tin tức mới
Tin tức mới APEC 2017: CUỘC "SÁT HẠCH" LỚN GIÚP VIỆT NAM SOI LẠI MÌNH
Làm chủ nhà APEC cho chúng ta thêm một cơ hội nhìn rõ hơn bản thân mình, xem trong một thế giới hội nhập, ta đang có gì và đang thiếu gì.
 Tin tức mới
Tin tức mới TUYÊN BỐ CHUNG VIỆT NAM - TRUNG QUỐC: SỰ PHÁT TRIỂN MỖI NƯỚC LÀ CƠ HỘI CỦA NHAU:
Ngày 13/11, Việt Nam và Trung Quốc đã ra tuyên bố chung nhân chuyến thăm chính thức Việt Nam của Tổng bí thư, Chủ tịch Trung Quốc Tập Cận Bình từ ngày 12 - 13/11.
 Tin tức mới
Tin tức mới NHỮNG CƠ HỘI VÀ THÁCH THỨC CỦA APEC
Những biến động mạnh mẽ về thương mại và an ninh trên thế giới đang tác động lớn đến APEC nhưng cũng tạo ra cơ hội phát triển.
 Tin tức mới
Tin tức mới CẦN XÂY DỰNG CHƯƠNG TRÌNH ĐÀO TẠO NGHỀ ĐẶC THÙ CHO NGƯỜI LAO ĐỘNG VIỆT NAM
Cuộc cách mạng công nghiệp lần thứ 4 sẽ dẫn đến sự thay đổi kỹ năng nghề, nhiều nghề sẽ biến mất, nhiều nghề mới hình thành… kéo theo đó là hàng loạt các vấn đề an sinh xã hội.
 Tin tức mới
Tin tức mới LIÊN KẾT PHÁT TRIỂN LIÊN HOÀN VÙNG DUYÊN HẢI MIỀN TRUNG
Vẫn còn sự lúng túng, bị động trong việc triển khai các bước liên kết phát triển vùng...
 Tin tức mới
Tin tức mới START-UP MUỐN XÂY DỰNG "UBER" TRONG NGÀNH CHĂM SÓC SỨC KHỎE
Khai phá ngành chăm sóc sức khoẻ tại nhà theo cách làm hoàn toàn mới, mới đây Homage nhận được khoản đầu tư 1,2 triệu USD...
 Tin tức mới
Tin tức mới VIỆT NAM VẪN LÀ ĐIỂM ĐẾN CỦA CÁC NHÀ ĐẦU TƯ NƯỚC NGOÀI
8 tháng thu hút FDI đã xấp xỉ cả năm 2016...
 Tin tức mới
Tin tức mới 10 VẤN ĐỀ ĐANG KHIẾN GIỚI DOANH NGHIỆP TOÀN CẦU " MẤT NGỦ"
Các vụ tấn công mạng đang là một trong những vấn đề khiến lãnh đạo doanh nghiệp trên thế giới lo ngại nhất hiện nay...
 Tin tức mới
Tin tức mới LÀN SÓNG KHỞI NGHIỆP TRONG NÔNG DÂN
Thực trạng nông nghiệp Việt Nam với nhiều hạn chế trong sản xuất đã khiến giá trị nông sản làm ra chưa cao và một bộ phận không nhỏ nông dân vẫn còn nghèo... ,
 Tin tức mới
Tin tức mới KHU KINH TẾ MỞ CHU LAI VÀ ĐƯỜNG ĐI "KHÔNG GIỐNG AI".
Chìa khoá thành công của Khu kinh tế mở Chu Lai là tinh thần luôn đồng hành cùng doanh nghiệp để tháo gỡ khó khăn chứ không sử dụng "quyền lực" của quản lý nhà nước...
 Tin tức mới
Tin tức mới VIỆT - THÁI HỢP TÁC ĐỂ TRỞ THÀNH TRUNG TÂM HÚT ĐẦU TƯ CỦA KHU VỰC
Chiều 17/8, ngay sau khi đến Bangkok, Thủ tướng Nguyễn Xuân Phúc đã có cuộc họp hẹp và hội đàm cùng Thủ tướng Thái Lan Prayuth Chan-o-cha nhân chuyến thăm quốc gia này từ 17 - 19/8.
 Tin tức mới
Tin tức mới VNPT ĐỒNG HÀNH THÚC ĐẨY IoT PHÁT TRIỂN
IoT (thiết bị gia dụng, công nghệ xe hơi, thiết bị cảm biến, thiết bị đeo, smartphone…) được coi là một trong những yếu tố cấu thành của cuộc cách mạng công nghiệp lần thứ 4
 Tin tức mới
Tin tức mới VIỆT NAM SẮP ĐÓN LÀN SÓNG ĐẦU TƯ MỚI VÀO HẠ TẦNG GIAO THÔNG
Nhiều nhà đầu tư nước ngoài đang quan tâm đến các hạ tầng giao thông Việt Nam...
 Tin tức mới
Tin tức mới TĂNG CƯỜNG QUẢNG BÁ LỊCH SỬ, VĂN HÓA VIỆT NAM QUA MỘC BẢN TRIỀU NGUYỄN
Sáng 6/8, Ủy viên Bộ Chính trị, Phó Thủ tướng Thường trực Chính phủ Trương Hòa Bình cùng đoàn công tác đã làm việc với Trung tâm Lưu trữ quốc gia IV, Cục Văn thư và Lưu trữ Nhà nước tại Đà Lạt.
 Tin tức mới
Tin tức mới VIỆT NAM TRONG NHÓM NƯỚC ĐƯỢC DỰ BÁO DẪN ĐẦU TĂNG TRƯỞNG KINH TẾ CHÂU Á
Đông Nam Á, trong đó có Việt Nam, đang nắm lấy vai trò dẫn đầu tăng trưởng kinh tế khu vực châu Á...
 Tin tức mới
Tin tức mới VIETTEL LÊN KẾ HOẠCH XÂM NHẬP HAI THỊ TRƯỜNG NỬA TỶ DÂN
Hai trong 10 quốc gia có dân số đông nhất thế giới đang nằm trong tầm ngắm của Viettel...
 Tin tức mới
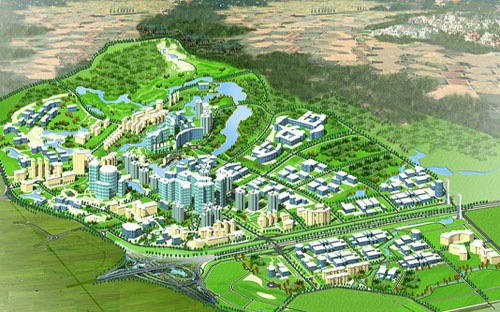
Tin tức mới LOẠT CƠ CHẾ ĐẶC THÙ CHO NHÀ ĐẦU TƯ TẠI KHU CÔNG NGHỆ CAO HÒA LẠC
Nhà đầu tư thực hiện dự án nhà ở cho người lao động làm việc tại khu công nghệ cao được hưởng ưu đãi về thuế, tiền thuê đất, tiền sử dụng đất...
 Tin tức mới
Tin tức mới ĐIỆN GIÓ- XU HƯỚNG PHÁT TRIỂN BỀN VỮNG
Đầu tư vào năng lượng tái tạo, đặc biệt là điện gió, từ lâu đã là một xu hướng được các nước phát triển trên thế giới quan tâm đẩy mạnh nhằm hướng tới phát triển bền vững.
 Tin tức mới
Tin tức mới FACEBOOK ĐƯA DỊCH VỤ TRUY CẬP KHÔNG DÂY KHÔNG CẦN INTERNET VÀO VIỆT NAM
Cho phép người dùng điện thoại di động truy cập Internet và Facebook mà không mất phí dữ liệu...
 Tin tức mới
Tin tức mới KINH TẾ TƯ NHÂN TRONG TIẾN TRÌNH PHÁT TRIỂN KINH TẾ-XÃ HỘI ĐẤT NƯỚC
Ngày 26/4/2017, Hội Doanh nhân Tư nhân Việt Nam (VPBA) chính thức tổ chức Diễn đàn kinh tế tư nhân lần thứ nhất. Nhân dịp này,
 Tin tức mới
Tin tức mới ÔNG VŨ NGỌC HOÀNG: “CẦN HIỂU ĐÚNG ĐỂ KHÔNG LÀM SAI”
Tư duy chưa đúng về kinh tế thị trường đã chịu ảnh hưởng của tư duy không đúng về vấn đề CNTB và CNXH.
 Tin tức mới
Tin tức mới VIỆT NAM LÀ 1 TRONG 3 NỀN KINH TẾ VIP CỦA CHÂU Á
Trong năm 2016 – 2017, Châu Á sẽ có 3 nền kinh tế VIP, dẫn đầu tăng trưởng ở khu vực, gồm Việt Nam, Ấn Độ và Philippines.
 Tin tức mới
Tin tức mới THAM VỌNG CỦA FPT TRONG CUỘC CÁCH MẠNG CÔNG NGHIỆP 4.0
Tại đại hội đồng cổ đông của Tập đoàn FPT (mã FPT) vừa diễn ra, Chủ tịch tập đoàn này, ông Trương Gia Bình đã chia sẻ với cổ đông những tham vọng trong cuộc cách mạng công nghiệp lần thứ 4 hay còn gọi là cuộc cách mạng công nghiệp 4.0.
 Tin tức mới
Tin tức mới TÌM CƠ HỘI TRONG CUỘC CÁCH MẠNG CÔNG NGHIỆP THỨ TƯ
Số luật sư sẽ giảm mạnh, công nghiệp ôtô truyền thống sẽ khủng hoảng, nhu cầu bất động sản sẽ thay đổi, và còn gì nữa?...
 Tin tức mới
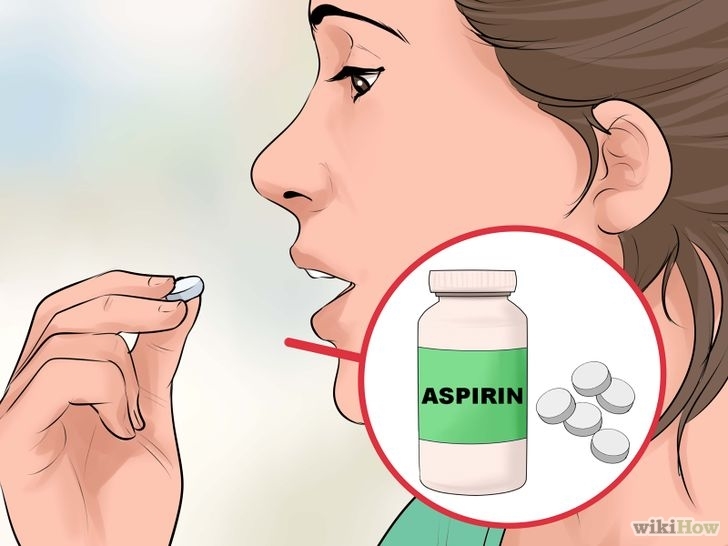
Tin tức mới NGƯỜI KHÔN NGOAN NHẤT ĐỊNH PHẢI THỦ 3 LOẠI "BÙA" NÀY TRÊN ĐẦU GIƯỜNG
Ở đây không đề cập đến những loại bùa chú trừ tà trong giới tâm linh, mà 3 loại bùa này bao gồm: 1 ly nước, 1 cây kim, 2 viên aspirin.
 Tin tức mới
Tin tức mới TỔNG GIÁM ĐỐC WB TÁI KHẲNG ĐỊNH CAM KẾT HỖ TRỢ VIỆT NAM
Hiện nay, WB đang có 49 chương trình và dự án tại Việt Nam, với tổng giá trị cam kết là 9,5 tỷ USD...
 Tin tức mới
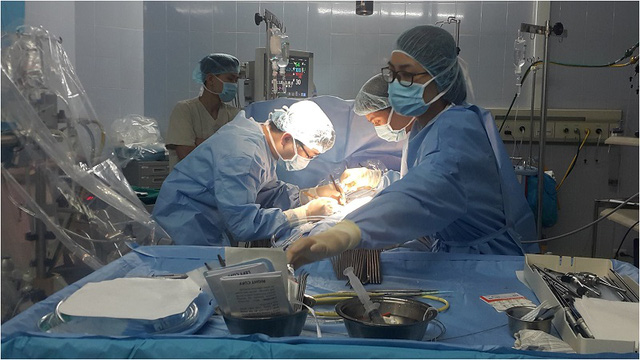
Tin tức mới KỸ THUẬT MỔ TIM KHÓ CỦA VIỆT NAM LẦN ĐẦU ĐƯỢC GIỚI THIỆU ĐẾN TOÀN THẾ GIỚI
Lần đầu tiên tại Hội nghị phẫu thuật tim mạch lồng ngực Vương quốc Anh, một kỹ thuật mổ tim của Việt Nam đã được giới thiệu, trình bày, nhận được sự đánh giá cao của đồng nghiệp thế giới bởi đây là một kỹ thuật khó, không phải Trung tâm tim mạch nào trên
 Tin tức mới
Tin tức mới NHIỀU NHÀ ĐẦU TƯ NGOẠI ĐỔ VỐN ĐẦU TƯ VÀO KHU VỰC BÁN LẺ VIỆT NAM
Động thái mới nhất của sự quan tâm này là hãng Hennes&Mauritz (H&M) – thương hiệu thời trang hàng đầu thế giới của Thụy Điển quyết định khai trương cửa hàng của mình tại Việt Nam trong năm nay.
 Tin tức mới
Tin tức mới GHI NHẬN CÔNG LAO CỦA NHÀ NGUYỄN
Sáng 22-2 tại Hà Nội, Ban Tuyên giáo trung ương tổ chức buổi thông tin khoa học “Một số thành tựu mới trong nghiên cứu lịch sử VN” do GS.NGND Phan Huy Lê - chủ tịch danh dự Hội Khoa học lịch sử VN - trình bày.
 Tin tức mới
Tin tức mới VÌ SAO NHÀ NƯỚC ĐỘC QUYỀN 20 LOẠI HÀNG HÓA, DỊCH VỤ?
Có những ý kiến trái chiều xung quanh dự thảo danh mục 20 loại hàng hóa, dịch vụ do Nhà nước độc quyền...
 Tin tức mới
Tin tức mới VIỆT NAM CÓ SÂM TỐT NHẤT THẾ GIỚI, "KHẮC TINH" CỦA UNG THƯ
Ít ai biết Việt Nam sở hữu loài sâm hiếm còn tốt hơn cả sâm Triều Tiên, Hàn Quốc, có tác dụng rất tốt với bệnh nhân ung thư.
 Tin tức mới
Tin tức mới BỐN DẤU HIỆU ĐÃ XUẤT HIỆN CỦA MỘT CƠN BÃO LỚN KHỦNG HOẢNG TÀI CHÍNH
Giai đoạn tiền khủng hoảng, giống như bầu trời trước bão, luôn có đầy đủ dấu hiệu cảnh báo cần thiết. Vậy tại sao các dấu hiệu của khủng hoảng tài chính vẫn luôn không được đánh giá và nhìn nhận đủ mức?
 Tin tức mới
Tin tức mới TOÀN VĂN PHÁT BIỂU CHIA TAY CỦA OBAMA
Tổng thống Barack Obama phát biểu chia tay Nhà Trắng tại thành phố quê nhà Chicago vào tối ngày 10/1, tức sáng ngày 11/1 giờ Hà Nội. Dưới đây là nội dung bài phát biểu của ông:
 Tin tức mới
Tin tức mới THỦ TƯỚNG: VÂN ĐỒN LÀ "PHÒNG THÍ NGHIỆM THỂ CHẾ CỦA VIỆT NAM”
Trong chuyến công tác tại Quảng Ninh, Thủ tướng đã đến thị sát một số dự án tại Vân Đồn như cảng hàng không Quảng Ninh, tổng vốn đầu tư 7.400 tỷ đồng; khu phức hợp nghỉ dưỡng giải trí cao cấp Vân Đồn, tổng vốn đầu tư 4.957 tỷ đồng.
 Tin tức mới
Tin tức mới NỢ TOÀN CẦU ĐẠT KỶ LỤC 152 NGHÌN TỶ USD: QỦA BOM NỔ CHẬM
8 năm sau cuộc khủng hoảng tài chính, thế giới lại đang gánh một lượng nợ lớn chưa từng có tiền lệ. “Núi nợ lớn hơn gấp đôi quy mô nền kinh tế và vượt xa GDP toàn cầu”, Quỹ Tiền tệ Quốc tế (IMF) cho biết.
 Tin tức mới
Tin tức mới LỰA CHỌN NÀO CỦA CHÍNH SÁCH TIỀN TỆ 2017?
“Điều hành chính sách tiền tệ của chúng ta không giống như các nước, chúng ta phục vụ đa mục tiêu”...
 Tin tức mới
Tin tức mới THỊ TRƯỜNG ASEAN QUAN TRỌNG NHƯ THẾ NÀO VỚI VIỆT NAM?
Với không gian thị trường 600 triệu dân, GDP dự kiến đạt 4,7 nghìn tỉ USD vào năm 2020 và tiềm năng trở thành nền kinh tế lớn thứ 4 thế giới vào năm 2030, AEC hứa hẹn sẽ mở ra rất nhiều cơ hội mới cho các doanh nghiệp Việt Nam
 Tin tức mới
Tin tức mới CEO VIETTEL HÉ LỘ BÍ QUYẾT THÀNH CÔNG VÀ TRIẾT LÝ "ĐƯỜNG DO ĐI MÀ CÓ"
Khát vọng vươn lên. Đam mê. Sáng tạo. Yêu công việc của mình dù ở vị trí nhỏ... Tất cả sẽ góp phần tạo nên thành công dù con đường ấy chưa ai từng đi. "Đường do đi mà có" là bài học rút ra từ thành công của Viettel trong suốt chặng đường qua.
 Tin tức mới
Tin tức mới CÔNG CUỘC "SẮP XẾP LẠI GIANG SƠN" TRƯỚC ĐẠI HỘI ĐỔI MỚI 1986
Cách đây hơn 30 năm, 60 tỉnh, thành cả nước được sáp nhập lại còn 29 với kỳ vọng trở thành những "pháo đài kinh tế".
 Tin tức mới
Tin tức mới ÔNG PHAN DIỄN: CHÚNG TA ĐÃ VƯỢT QUA SỰ "KIÊU NGẠO CỘNG SẢN"
Sau 1975, tâm ký kiêu ngạo của người chiến thắng là một trong những nguyên nhân gây ra nhiều khủng hoảng khiến Việt Nam "phải đau đớn trả giá",
 Tin tức mới
Tin tức mới THAY ĐỔI TƯ DUY QUYỀN LỰC
Đi tìm câu trả lời cho câu hỏi: Làm thế nào để đẩy mạnh xã hội hóa thu hút đầu tư tư nhân trong thời gian tới, chúng tôi đã gặp ông Lê Văn Tăng, Trưởng Khoa danh dự Khoa Đấu thầu, Học Viện Chính sách và Phát triển, nguyên Cục trưởng Cục Quản lý đấu thầu
 Tin tức mới
Tin tức mới XÓA NGAY QUAN HỆ THÂN HỮU ĐANG BÓP CHẾT LÀM ĂN CHÂN CHÍNH
Phải xóa bỏ ngay tình trạng quan hệ thân hữu đang bóp chết việc làm ăn chân chính, xóa bỏ tư tưởng quan hệ tốt với chính quyền sẽ có cơ hội tiếp cận tốt hơn tài nguyên, đất đai, thể chế và các ưu đãi ngầm - Thủ tướng nói.
 Tin tức mới
Tin tức mới NHẬN DIỆN NGUY CƠ "TỰ DIỄN BIẾN", "TỰ CHUYỂN HÓA"' TRONG LĨNH VỰC BÁO CHÍ VÀ MỘT SỐ GIẢI PHÁP KHẮC PHỤC (KỲ 2)
Kỳ 2 của bài viết phân tích rõ xu hướng hư vô về chính trị, thiếu đạo đức nghề nghiệp trong một bộ phận người làm báo; Sự thiếu trách nhiệm, bất cập trong công tác chỉ đạo, quản lý của một số cơ quan chủ quản báo chí.
 Tin tức mới
Tin tức mới NHẬN DIỆN NGUY CƠ "TỰ DIỄN BIẾN", "TỰ CHUYỂN HÓA" TRONG LĨNH VỰC BÁO CHÍ VÀ MỘT SỐ GIẢI PHÁP KHẮC PHỤC
Một trong những vấn đề quan trọng được thẳng thắn chỉ ra và thảo luận tại hội nghị lần thứ tư Ban chấp hành TƯ Đảng vừa qua là biểu hiện của “tự diễn biến”, “tự chuyển hóa”.
 Tin tức mới
Tin tức mới LÀNH MANH HÓA BỘ MÁY HÀNH CHÍNH
Một cấp chính quyền tốt hay xấu phụ thuộc rất nhiều vào cách làm việc và năng lực của công chức chính quyền ấy.
 Tin tức mới
Tin tức mới “ĐẦU TƯ ĐIỆN HẠT NHÂN KHÔNG CÒN CẤP THIẾT”
Việc đầu tư điện hạt nhân không cạnh tranh được với các nguồn năng lượng khác về mặt kinh tế...
 Tin tức mới
Tin tức mới CÔNG NGHIỆP Ô TÔ VÀ KẺ NGƯỚC DÒNG TRƯỜNG HẢI
Phát triển một thương hiệu ôtô “thuần Việt” lúc này vừa là tham vọng viển vông và vừa không cần thiết...
 Tin tức mới
Tin tức mới "ĐẬP TAN" THOÁI HÓA ĐỐT SỐNG CỔ BẰNG NƯỚC LÁ CÂY MẬT GẤU PHA VỚI...BIA
“Được bạn chỉ cách chữa thoái hóa đốt sống cổ, tôi về nhà hái lá mật gấu rồi đem giã nát, lấy nước, pha cùng với bia uống. Hơn nửa tháng sau các cơn đau dứt hẳn, tay chân hoạt động linh hoạt bình thường…”, ông Đàm Hạp chia sẻ.
 Tin tức mới
Tin tức mới BỨC THƯ CỦA NGƯỜI CHA VỀ 9 ĐIỀU MUỐN CON LUÔN NHỚ TRONG CUỘC ĐỜI
"Trên đường đời, con sẽ gặp những người đối xử tệ với mình. Đừng để tâm. Không ai có bổn phận phải đối xử tốt với con, trừ bố mẹ".
 Tin tức mới
Tin tức mới SỰ NGUY HIỂM CỦA "THẾ GIỚI ẢO”
Những câu chuyện nhảm nhí đến mức không thể tin nổi trên mạng xã hội trở thành sự thật ngoài đời thường đang diễn ra một cách đáng báo động.
 Tin tức mới
Tin tức mới TẦNG LỚP TRUNG LƯU CÓ THỂ CHIẾM 1/2 DÂN SỐ VIỆT NAM VÀI NĂM TỚI
Tờ Nikkei nói rằng với thu nhập ngày càng tăng, người Việt ngày càng ưa thích các thương hiệu nước ngoài nổi tiếng...
 Tin tức mới
Tin tức mới CHUYÊN GIA QUỐC TẾ HIẾN KẾ XÂY DỰNG "THÀNH PHỐ THÔNG MINH"
Vừa qua, tại TPHCM đã diễn ra hội thảo “Giải pháp tổng thể xây dựng mô hình thành phố thông minh và các giải pháp triển khai tại TPHCM”.
 Tin tức mới
Tin tức mới “GIÁO DỤC HỎNG CHÍNH LÀ DO TRIẾT LÝ GIÁO DỤC SAI LẦM"
Cách đây 4 năm, cũng trên Báo Lao Động, GS.TSKH. Trần Ngọc Thêm đã thẳng thắn chỉ ra 4 trọng bệnh của nền giáo dục VN là: Bệnh thành tích, bệnh cào bằng, bệnh suy dinh dưỡng và bệnh gian dối.
 Tin tức mới
Tin tức mới CẢ LÀNG LÊN HÀ NỘI BÁN KẸO LẠC: ĐƯỜNG TẮC ĐẾN THẾ KỶ SAU
Nếu tiếp tục chỉ tập trung đầu tư cho thành phố, không có giải pháp quyết liệt thì đường Hà Nội sẽ còn tắc lâu dài.
 Tin tức mới
Tin tức mới "TP HCM KHÔNG HẾT NGẬP, KHÔNG LẤY TIỀN"
Những ngày qua, giữa trận ngập lụt kinh hoàng xảy ra tại TP.HCM, ông Nguyễn Tăng Cường – Tổng giám đốc Tập đoàn Công nghiệp Quang Trung (Ninh Bình) trở thành từ khoá “hot” khi đưa ra giải pháp chống ngập úng cho TP.HCM với cam kết “không hết ngập, không l
 Tin tức mới
Tin tức mới CHỈ 15 NĂM NỮA HÀ NỘI SẼ LÀ SIÊU THÀNH PHỐ, SÁNH NGANG VỚI TRUNG TÂM TÀI CHÍNH CỦA HONGKONG
Hà Nội mạnh, đất nước mới mạnh. Mục tiêu của Hà Nội sau năm 2030 sẽ là một siêu thành phố. Thủ đô sẽ là một trung tâm tài chính sánh ngang trung tâm tài chính của Hongkong, Singapore.
 Tin tức mới
Tin tức mới BÀN VỀ SỰ BÓC LỘT VÀ THÂU TÓM QUYỀN LỰC
Nếu không ngăn được “nhóm lợi ích”, Đảng chân chính sẽ không còn và Nhà nước sẽ biến chất, dân tộc sẽ bị bóc lột, bị tước đoạt quyền lực và tài sản của cải, xã hội sẽ không có dân chủ và tự do, không có bình đẳng.
 Tin tức mới
Tin tức mới 4 SAI LẦM KINH ĐIỂN CỦA BỐ MẸ VIỆT NAM
Phần lớn phụ huynh Việt Nam đều biết chiều con là có hại nhưng họ không hiểu được thế nào là nuông chiều, càng không biết được có phải bản thân mình đang nuông chiều con hay không.
 Tin tức mới
Tin tức mới NGƯỜI NHẬT LÀM ĐẾN GIÀ, NGƯỜI VIỆT CHỈ MUỐN NGHỈ HƯU SỚM
Một cụ ông làm việc tới 101 tuổi mới nghỉ hưu là một câu chuyện đáng suy ngẫm về tinh thần của người Nhật. Với nhiều người già ở Nhật Bản, công việc không phải là gánh nặng mà ngược lại, là niềm tự hào, niềm vui trong cuộc sống. Trong khi đó, tại Việt Nam
 Tin tức mới
Tin tức mới "THAN VIỆT NAM ĐỦ KHAI THÁC VÀI TRĂM NĂM NỮA"
Với tổng tài nguyên trữ lượng cụ thể của than sông Hồng, nếu bể này thành công, thì tài nguyên than rất lớn có thể khai thác vài trăm năm và lên tới hàng chục tỷ tấn. Riêng dải Khoái Châu - Tiền Hải dự tính khai thác được khoảng 42 tỷ tấn.
 Tin tức mới
Tin tức mới VIỆT NAM ĐANG SỞ HỮU MỘT LOẠI QUẢ ĐƯỢC MỆNH DANH LÀ "CỨU TINH CỦA THẾ GIỚI"
Đó chính là quả mít - loại quả có thể cứu đói cả triệu người trên thế giới.
 Tin tức mới
Tin tức mới DIỄN VĂN KHAI GIẢNG CỦA GIÁO SƯ VĂN NHƯ CƯƠNG
Hôm nay khai giảng lần thứ 26 trường Lương Thế Vinh, sau đây là bài phát biểu của tôi:
 Tin tức mới
Tin tức mới NHỮNG NGƯỜI VƯỢT ĐÈN ĐỎ THƯỜNG KHÔNG THÀNH ĐẠT TRONG CUỘC SỐNG
Đa số chúng ta đều cho rằng vượt đèn đỏ chỉ là một hành vi vi phạm luật an toàn giao thông. Rất đơn giản và dễ hiểu!
 Tin tức mới
Tin tức mới QÚA TRÌNH PHÊ DUYỆT TPP “GẶP PHỨC TẠP TỪ PHÍA MỸ”
Báo cáo tại phiên họp của Ban Chỉ đạo liên ngành hội nhập quốc tế và kinh tế, Thứ trưởng Bộ Công Thương Trần Quốc Khánh nói, quá trình phê duyệt Hiệp định Đối tác xuyên Thái Bình Dương (TPP) với Mỹ đang có phần phức tạp, khi hai ứng viên Tổng thống sắp tớ
 Tin tức mới
Tin tức mới KIẾN NGHỊ CHƯA CHO FORMOSA VẬN HÀNH CHÍNH THỨC
Kết quả kiểm tra về nước thải, khí thải, chất thải rắn và tình hình sử dụng hóa chất tại nhà máy Formosa Hà Tĩnh cho thấy một số nội dung chưa đạt yêu cầu...
 Tin tức mới
Tin tức mới 'GÓC KHUẤT" ĐẰNG SAU THÀNH CÔNG CỦA TỶ PHÚ GIẦU NHẤT VIỆT NAM
Là người đi lên từ bàn tay trắng và làm được những điều không ai tin là có thể, tỷ phú Phạm Nhật Vượng cũng có những 'góc khuất' đằng sau thành công.
 Tin tức mới
Tin tức mới TÂM SỰ CỦA MỘT KỸ SƯ NHẬT BẢN
Một kỹ sư Nhật khi về nước đã không ngại ngần nói với người công nhân VN: ‘Người Việt các anh sẽ muôn đời khổ.
 Tin tức mới
Tin tức mới NHIỀU NGƯỜI KHỎI BỆNH NHỜ CÂY MẬT GẤU
Nhiều người bệnh khẳng định công dụng chữa bệnh thần kỳ của cây Mật Gấu - Kim Thất Tai, họ đã chữa hết bệnh khớp, tiểu đường, thậm chí bệnh trĩ… chỉ nhờ uống nước lá Mật Gấu thay trà.
 Tin tức mới
Tin tức mới TĂNG CƯỜNG QUẢN LÝ VÀ KHAI THÁC CÁC THỊ TRƯỜNG KHÁCH DU LỊCH TRỌNG ĐIỂM
Ngày 1/8, Tổng cục Du lịch đã có công văn gửi các Sở Du lịch, Sở Văn hóa, Thể thao, Du lịch (VHTTDL) các tỉnh, thành phố vê việc tăng cường quản lý và khai thác các thị trường khách du lịch trọng điểm.
 Tin tức mới
Tin tức mới CÓ NÊN HẠN CHẾ XE CÁ NHÂN?
Vừa qua, lần đầu tiên lãnh đạo TP Hà Nội có chủ trương hạn chế phương tiện cá nhân và có lộ trình đến năm 2025 sẽ dừng hoạt động loại phương tiên này trong nội đô. Chủ trương này đã và đang nhận được nhiều ý kiến trong dư luận...
 Tin tức mới
Tin tức mới NGUY HIỂM CỦA FORMOSA VÀ SỰ NGÂY NGÔ KHÓ HIỂU !
Bài viết sau đây của tác giả Thành Nam, một doanh nhân Khoáng sản và Luyện kim.
 Tin tức mới
Tin tức mới UỐNG BIA TỐT CHO CẢ ĐÀN ÔNG VÀ ĐÀN BÀ
rước đây chúng ta vẫn thường quan niệm thức uống liên quan đến cồn đều không tốt nhưng nghiên cứu của các nhà khoa học đã khẳng định rằng bia tốt cho sức khỏe cả đàn ông và đàn bà.
 Tin tức mới
Tin tức mới DANH SÁCH CÁC LOẠI CÂY CẢNH CHỨA CHẤT ĐỘC
Tiến sĩ sinh học Bùi Văn Lệ, trường Đại học Khoa học Tự nhiên TP HCM cho biết, gia đình có trẻ nhỏ tốt nhất không nên trồng các loại hoa, cây cảnh. Vì có thể loại hoa cây cảnh đó cực kỳ độc mà bố mẹ không biết.
 Tin tức mới
Tin tức mới FORMOSA XIN LỖI GÂY Ô NHIỄM BIỂN MIỀN TRUNG, CAM KẾT BỒI THƯỜNG
Formosa bồi thường thiệt hại kinh tế cho người dân và bồi thường xử lý môi trường biển tổng cộng 500 triệu USD (11.500 tỷ đồng)...
 Tin tức mới
Tin tức mới DOANH NGHIỆP CAM KẾT RÓT 300 NGHÌN TỶ VÀO HÀ NỘI
Trong 4 năm tới, Hà Nội có đến 95 dự án với tổng mức đầu tư dự kiến hơn 710.000 tỷ đồng cần kêu gọi đầu tư...
 Tin tức mới
Tin tức mới “BÁO CHÍ PHẢI ĐỒNG HÀNH CÙNG DOANH NGHIỆP ĐỂ PHÁT TRIỂN ĐẤT NƯỚC“
Chiều 10/6, tại Trụ sở Chính phủ, Thủ tướng Nguyễn Xuân Phúc tiếp Đoàn các nhà báo tham gia chương trình báo chí đồng hành cùng doanh nghiệp, doanh nhân lần thứ 2.
 Tin tức mới
Tin tức mới ĐẠI GIA NGUYỄN VĂN TRƯỜNG VỚI NHỮNG DỰ ÁN TÂM LINH NGHÌN TỶ
Trước khi công bố sẽ xây Tháp Phật giáo lớn bậc nhất thế giới tại Thái Nguyên, doanh nhân Nguyễn Văn Trường được biết đến là chủ đầu tư nhiều dự án du lịch tâm linh có giá trị đầu tư hàng chục nghìn tỷ đồng ở nhiều tỉnh, thành phía Bắc.
 Tin tức mới
Tin tức mới 7 LỢI ÍCH TUYỆT VỜI CỦA KHIÊU VŨ
Khiêu vũ không chỉ giúp bạn giảm cân mà còn giúp hệ thống xương trở nên chắc khỏe, tăng cường trí nhớ, làm chậm quá trình lão hóa và giúp bạn chống lại stress một cách hữu hiệu.
 Tin tức mới
Tin tức mới “BA THẾ MẠNH CỦA DOANH NGHIỆP TƯ NHÂN”
Ghi nhận tại Diễn đàn Kinh tế tư nhân Việt Nam (VPSF) lần thứ nhất, được Hội Doanh nhân trẻ Việt Nam tổ chức...
 Tin tức mới
Tin tức mới “VIỆT NAM LÀ THIÊN ĐƯỜNG CHO KHỞI NGHIỆP”
Phó thủ tướng nói ông rất suy nghĩ khi nghe một ý kiến cho rằng chỉ có doanh nghiệp thất bại, chứ Chính phủ không bao giờ thất bại...
 Tin tức mới
Tin tức mới NHỮNG ĐIỀU CẦN LƯU Ý KHI Ở KHÁCH SẠN
Khách sạn là nơi có rất nhiều người nghỉ qua đêm, nên cần phải làm một số điều gọi là “thủ tục” và kiêng kị một số hành động khi nghỉ qua đêm ở bất kỳ một khách sạn nào.
 Tin tức mới
Tin tức mới CÓ THỂ KHẮC PHỤC “CHỦ NGHĨA THÂN HỮU” Ở VIỆT NAM KHÔNG?
Báo cáo “Việt Nam 2035” đưa ra những ngôn ngữ mà báo cáo chính thống trước đây chưa dùng đến...
 Tin tức mới
Tin tức mới CHỆCH HƯỚNG SANG “CNTB THÂN HỮU”: NGUY CƠ CÓ THẬT!
“Nguy cơ hiện hữu đáng lo nhất là chệch sang “Chủ nghĩa tư bản thân hữu” – một hiện tượng, sự biến tướng, sự tha hóa chứ không phải là giai đoạn phát triển nào của chủ nghĩa tư bản”, Vũ Ngọc Hoàng.
 Tin tức mới
Tin tức mới KỂ TỪ GIỜ
Kể từ giờ em hãy sống vì em Dù mạnh mẽ, hay yếu mềm, cũng được. Miễn thản nhiên cười và vô tư bước, Đau khổ hay không là tự do mình.
 Tin tức mới
Tin tức mới XU THẾ DỠ BỎ CÁC ĐẬP TRÊN SÔNG TRÊN KHẮP THẾ GIỚI
Trong khi Việt Nam đang có đề xuất xây dựng 6 đập dọc sông Hồng trong một dự án tỷ đô, thì nhiều nước trên thế giới đang bỏ tiền tháo dỡ các đập để trả lại dòng chảy cho sông.
 Tin tức mới
Tin tức mới TẬP THỂ DỤC ĐÚNG: LÚC NÀO, BAO LÂU VÀ Ở ĐÂU?
Ai cũng biết, tập thể dục dưỡng sinh là rất cần thiết để bảo vệ sức khỏe cũng như để chữa bệnh. Nhưng tập thể dục thế nào cho đúng, cho hiệu quả thì thường chưa được lưu ý đúng mức
 Tin tức mới
Tin tức mới ÔI THỜI GIAN !
Con đừng chê mẹ nghe con Bởi con giờ vẫn đang son con à! Mai sau con xế tuổi già Chắc gì đã được như là mẹ đây?
 Tin tức mới
Tin tức mới QÚA NHIỀU NHẬN THỨC SAI LẦM VỀ BẰNG TIẾN SĨ
Học tiến sĩ không phải để đào tạo nhà quản lý hoặc lãnh đạo; luận án tiến sĩ không nhằm nghiên cứu vấn đề thực tiễn áp dụng ngay cho việc phát triển kinh tế - xã hội.
 Tin tức mới
Tin tức mới LỊCH SỬ NGÀY QUỐC TẾ LAO ĐỘNG 1-5
Hằng năm, người lao động trên toàn thế giới lại cùng nhau kỷ niệm ngày Quốc tế Lao động 1/5
 Tin tức mới
Tin tức mới CÓ 18 ĐỜI VUA HÙNG, VẬY NGÀY 10-3 LÀ GIỖ VỊ VUA NÀO?
Vào ngày Giỗ tổ, người người nô nức hướng về Đền Hùng thắp hương để tưởng nhớ về cội nguồn dân tộc. Nhưng cụ thể là giỗ ai, chưa chắc đã có người biết.
 Tin tức mới
Tin tức mới THẢM HỌA MEKONG TỪ 1 BÁO CÁO NGUY HIỂM CHO ĐẤT NƯỚC
Một bài báo rất quan trọng của TS Nguyễn Ngọc Trân, nguyên Phó Chủ nhiệm Ủy ban Khoa học và kỹ thuật nhà nước, nguyên chủ nhiệm Chương trình nhà nước điều tra cơ bản tổng hợp đồng bằng sông Cửu Long (1983 - 1990), đại biểu Quốc hội các khóa IX, X, XI, ngu
 Tin tức mới
Tin tức mới VÌ SAO NGƯỜI VIỆT NAM ÍT THÂN THIỆN VỚI NGƯỜI TRUNG QUỐC?
Hôm nay [17/02/2009] là một ngày nhân dân hai nước Trung Quốc, Việt Nam đều không thể nào quên.
 Tin tức mới
Tin tức mới VIỆT NAM THIỆT HẠI 8.700 TỶ ĐỒNG VÌ VIUS MÁY TÍNH NĂM 2015
Báo cáo tổng kết an ninh mạng năm 2015 do tập đoàn Bkav vừa công bố cho biết, trong năm vừa qua, virus máy tính gây thiệt hại đối với người dùng Việt Nam có giá trị lên tới 8.700 tỷ đồng, cao hơn so với mức 8.500 tỷ đồng năm 2014.
 Tin tức mới
Tin tức mới 7 XU HƯỚNG TÁC ĐỘNG ĐẾN BẤT ĐỘNG SẢN NĂM 2016
Việt Nam hội nhập sâu rộng với thế giới, áp lực dư cung căn hộ cao cấp lớn dần, tiếp thị số, đội quân bán hàng trực tuyến và quảng bá bằng người nổi tiếng... được dự báo là chất xúc tác ảnh hưởng đáng kể đến thị trường địa ốc năm 2016.
 Tin tức mới
Tin tức mới ĐẶC TÍNH CỦA NGƯỜI VIỆT QUA NHẬN XÉT CỦA VIỆN NGHIÊN CỨU MỸ
Viện Nghiên Cứu Xã Hội Học Hoa Kỳ (American Institute for Social Research) sau khi nghiên cứu đã chỉ ra 10 đặc tính căn bản của người Việt.
 Tin tức mới
Tin tức mới THẤT BẠI KHI MỘT DÂN TỘC PHẢI DỰA DẪM THÁNH THẦN MÀ ĐI
Cái sảy nảy cái ung, nếu không cẩn thận, hệ quả của các lễ hội không chỉ dừng lại ở sự nhốn nháo mà còn có nguy cơ đẩy dân tộc đến chỗ yếu đuối, tự ti và bạc nhược.
 Tin tức mới
Tin tức mới TRI THIÊN MỆNH
Sức mạnh của trẻ thơ là tiếng khóc. Sức mạnh của đàn bà là phẩn nộ. Sức mạnh của người ăn trộm là vũ khí.
 Tin tức mới
Tin tức mới BUÔNG BỎ LÀ MỘT LOẠI TRÍ TUỆ, BIẾT BUÔNG BỎ MỚI CÓ ĐƯỢC HẠNH PHÚC
Chúng ta thường nói muốn “buông bỏ”, nhưng rốt cuộc là “buông bỏ” điều gì chúng ta đã hiểu rõ chăng? Trong cuộc đời, nếu có thể buông bỏ những loại tâm dưới đây, bạn nhất định sẽ được bình thản và hạnh phúc!
 Tin tức mới
Tin tức mới LÀ AI KHÔNG QUAN TRỌNG, QUAN TRỌNG LÀ Ở CẠNH AI?
➤➤ Đi cùng ruồi thì tìm được nhà vệ sinh ➤➤ Đi cùng ong thì tìm được hoa thơm ➤➤ Đi cùng người giàu học cách kiếm nhiều tiền ➤➤ Đi cùng ăn mày học được cách xin cơm..
 Tin tức mới
Tin tức mới ĐẶT LẠI VẤN ĐỀ NGUỒN GỐC DÂN TỘC VÀ VĂN MINH VIỆT NAM
Hỏi một người Việt bình thường về nguồn gốc dân tộc Việt Nam, câu trả lời mà người ta thường nghe là tổ tiên của chúng ta xuất phát từ Trung Quốc. Ngay cả người có kiến thức rộng, có quan tâm đến dân tộc và văn hóa Việt cũng có những ý kiến tương tự.
 Tin tức mới
Tin tức mới ĐÂU LÀ GIÁ TRỊ CỦA NGƯỜI VIỆT NAM?
Một dân tộc muốn phát triển phải có giá trị chung làm động lực quốc gia. Với người Mỹ, đó là giấc mơ Mỹ, nơi mỗi cá nhân đều có cơ hội công bằng để thành công. Đối với người Nhật, đó là năm giá trị cốt lõi: tự do, dân chủ, nhân quyền, kinh tế thị trường
 Tin tức mới
Tin tức mới CHUYỆN "ÔNG TÁO" TRONG VĂN HÓA DÂN GIAN Á ĐÔNG
Hình tượng Táo quân đã tồn tại trong tín ngưỡng dân gian của nhiều nước Châu Á từ lâu. Theo quan niệm truyền thống, ông Táo vừa là thần bếp trong nhà vừa là người ghi chép lại tất cả những việc làm tốt xấu của con người trong năm cũ.
 Tin tức mới
Tin tức mới TỰ DO VÀ CHỦ NGHĨA XÃ HỘI
Khi nào và ở đâu mà những người lãnh đạo lãng quên vấn đề tự do, hạn chế tự do cũng có nghĩa là vô tình rời bỏ mục tiêu XHCN.
 Tin tức mới
Tin tức mới TÍN NGƯỠNG VÀ TÔN GIÁO Ở VIỆT NAM
Việt Nam là một quốc gia đa tôn giáo, tín ngưỡng. Người dân Việt Nam có truyền thống sinh hoạt, hoạt động tín ngưỡng từ lâu đời. Các dân tộc trong cộng đồng các dân tộc Việt Nam đều có những tín ngưỡng riêng gắn liền với đời sống kinh tế và tâm linh của m
 Tin tức mới
Tin tức mới “THẾ GIỚI CÓ THỂ NGẬP TRONG DẦU THỪA”
Lượng dầu tồn kho trên toàn cầu có thể tăng thêm 285 triệu thùng trong năm nay...
 Tin tức mới
Tin tức mới ĐÔI NÉT VỀ VĂN HÓA VIỆT NAM
Đời sống gia đình: Trong xã hội truyền thống Việt Nam trước đây, một gia đình điển hình thường bao gồm ba, bốn thế hệ cùng sống chung. Với tâm lý "nhiều con, nhiều lộc" nên mọi gia đình mong muốn "con đàn, cháu đống”.
 Tin tức mới
Tin tức mới HỘI NGƯỜI VIỆT NAM TẠI ROMANIA ĐIỂM TỰA TINH THẦN CHO NGƯỜI VIỆT XA QUÊ
Nhân dịp giao lưu với Trung tâm Dịch vụ và Hợp tác với người Việt Nam ở nước ngoài (Kiều Bào Việt), anh Điện Văn Hùng, người phụ trách công tác văn hóa thể thao của Hội người Việt Nam tại Romania đã thông tin về tình hình người Việt tại Romania:
 Tin tức mới
Tin tức mới PHÁC HOẠ BỨC TRANH KINH TẾ THẾ GIỚI 2016
Tính tới thời điểm này, luồng phân tích chính từ các tổ chức tài chính uy tín trên thế giới đều nhìn nhận kinh tế thế giới 2016 không có nhiều tín hiệu khả quan.
 Tin tức mới
Tin tức mới BÁO CHÍ THẾ GIỚI NÓI VỀ CỘNG ĐỒNG ASEAN
Báo chí khu vực và thế giới dành nhiều bài viết đánh giá và phân tích về dấu mốc Cộng đồng ASEAN (AC) thành lập.
 Tin tức mới
Tin tức mới NGUỒN GỐC VÀ Ý NGHĨA CỦA NGÀY LỄ GIÁNG SINH (NOEL) 25/12
Lễ Giáng sinh, còn được gọi là lễ Thiên Chúa giáng sinh, Nô-el, hay Nô-en (từ tiếng Pháp Noël, là viết tắt từ gốc Em-ma-nu-el, nghĩa là Thiên Chúa ở cùng chúng ta) là một ngày lễ quốc tế kỷ niệm ngày Chúa Giê-su sinh ra đời của phần lớn người Cơ Đốc giáo.
 Tin tức mới
Tin tức mới NGẪM MÌNH
Tuyết rơi phủ trắng đất trời Phố phường im lặng, lòng người buồn tênh Ngẫm mình đây đó lênh đênh Sáu năm rồi vẫn gập ghềng bước chân
 Tin tức mới
Tin tức mới NHỚ MÃI NHỮNG MÙA THU
Một cánh lá vàng bay nhẹ nhẹ Một màu Thu đọng lại trong đời Một sắc Thu xanh trời se lạnh Một chút bâng khuâng lắng lòng nguời
 Tin tức mới
Tin tức mới RUMANI, TÌNH YÊU CỦA TA
Kính tặng : Đất Nước và Nhân Dân Rumani yêu quý, nhân kỷ niệm 50 năm Đoàn 100 lưu học sinh Việt Nam đến Bucaret học tập và tu nghiệp.
 Tin tức mới
Tin tức mới TRỞ LẠI RUMANI
Bùi Trọng Đỉnh, CSV ĐHBK Cluj-Napoca, Khoá 1968-1974 (Viết trong chuyến thăm lại Rumani, Hè 2007)
 Tin tức mới
Tin tức mới CHÙM THƠ CỦA ĐẶNG TRẦN GIAO
Tác giả: Đặng Trần Giao là CSV Trường ĐHDK Bucarest , Khoá 1966-1972.
 Tin tức mới
Tin tức mới LÂU ĐÀI DRACULA- VIÊN NGỌC QUÍ CỦA ĐẤT NƯỚC RUMANI
Lâu đài Bran được xem như là một trong những công trình nổi tiếng nhất của kiến trúc thời Trung Cổ, được du khách khắp nơi trên thế giới biết đến với cái tên “Lâu đài Dracula”.
 Tin tức mới
Tin tức mới NỬA THẾ KỶ GIAO LƯU VĂN HỌC VIỆT NAM - RUMANI
Văn học Rumani dịch sang tiếng Việt và văn học Việt Nam được dịch ra tiếng Rumani không nhiều so với các nền văn học khác, mặc dù vậy những dấu ấn của văn học cũng đã để lại đậm nét trong lòng bạn đọc hai nước.
 Tin tức mới
Tin tức mới XIN ĐỪNG QUÊN EM…
Một ngày nghỉ đông ở Bucarest, tiết trời khá lạnh. Giáo sư Popescu dạy môn văn học dân gian, ông trợ giáo Petroiu cùng một nhóm sinh viên gồm hai sinh viên Rumani: Ion và Radu và hai sinh viên Việt Nam Tráng và Đàn trên một chiếc ôtô lên đường đi thăm cản
 Tin tức mới
Tin tức mới VĂN HỌC RUMANI GIẢN LƯỢC - MỘT MÓN QUÀ CỦA NGHĨA TÌNH
PGS.TS Lê Nguyên Cẩn Khoa Ngữ Văn –ĐHSP Hà Nội
 Tin tức mới
Tin tức mới HOA SALCÂM
Lưu Cẩm Bình CSV BK IASI, khóa 1967-1973 Nhân đọc bài thơ “Seara pe deal” của Mihai Eminescu.
 Tin tức mới
Tin tức mới ROMANIA, NGÀY TRỞ LẠI
România bốn mươi năm xa Gặp nhau, dâng trào nước mắt Nơi ta gửi tuổi thanh xuân đẹp nhất Chắp cánh ta bay khắp bốn phương trời
 Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới  Tin tức mới
Tin tức mới